Klonale Hämatopoese von unbestimmtem Potential (CHIP) in der Hämatologie
- Methode:
- Antikoagulans:
- Empfehlung:
- Methode:Zytomorphologie
- Antikoagulans:EDTA
- Empfehlung:obligat*
- Methode:Immunphänotypisierung
- Antikoagulans:
- Empfehlung:nein
- Methode:Chromosomenanalyse
- Antikoagulans:Heparin
- Empfehlung:nein
- Methode:FISH
- Antikoagulans:EDTA oder Heparin
- Empfehlung:nein
- Methode:Molekulargenetik
- Antikoagulans:EDTA oder Heparin
- Empfehlung:obligat
*bei positiver Molekulargenetik
Auf Basis der aktuellen Leitlinien und des aktuellen Forschungsstandes ergeben sich verschiedene diagnostische Empfehlungen für Patienten mit klonaler Hämatopoese von unbestimmtem Potenzial. Wir haben Ihnen die wichtigsten Infos zur Klassifikation und den diagnostischen Methoden am MLL zusammengefasst. Zudem haben wir weiterführende Links und Literatur zu klonaler Hämatopoese von unbestimmtem Potenzial zusammengestellt.
CHIP in der Hämatologie: Klassifikation
Die klonale Hämatopoese von unbestimmtem Potenzial (clonal hematopoiesis of indeterminate potential, CHIP) wird gemäß der WHO-Klassifikation 2022 zu den myeloischen Vorläuferläsionen gezählt.
CHIP-Definition der WHO 2022 (WHO 2022)
- Nachweis einer oder mehrerer somatischer Mutationen mit Varianter Allelfrequenz (VAF) ≥2% (≥4% für X-chromosomale Genmutationen bei Männern) in der DNA von Blut- oder Knochenmarkzellen, die ausgewählte Gene betreffen (siehe Molekulargenetik, Tabelle 2)
- Fehlen von unerklärlichen Zytopenien
- Diagnosekriterien für myeloische Neoplasmen werden nicht erfüllt
CHIP ist bei Personen unter 40 Jahren selten und nimmt nach 65 Jahren stetig zu. Bei älteren Personen betrifft sie zwischen 10-40%, wobei die Prävalenz auch von der Sensitivität der diagnostischen Sequenziermethode abhängt (Haferlach & Heuser 2022, WHO 2022).
Bei Individuen mit CHIP zeigt sich ein erhöhtes Risiko für die Entwicklung einer hämatologischen Neoplasie. Auch das Risiko für andere Erkrankungen, wie z. B. kardiovaskuläre Erkrankungen ist bei Vorliegen von CHIP erhöht. Hier können Sie sich über CHIP in der Kardiologie informieren.
Abgrenzung von CHIP zu CCUS und MDS
Bei Nachweis von Klonalität der Hämatopoese ist eine Abgrenzung von CHIP zu CCUS (klonale Zytopenie unbestimmter Signifikanz) und dem Vollbild myeloischer Neoplasien, insbesondere myelodysplastischer Neoplasien (MDS) notwendig.
Besteht bei Vorliegen einer klonalen Hämatopoese zusätzlich eine Zytopenie unklarer Ursache, so wird dies als CCUS bezeichnet. Wenn zudem auch noch zytomorphologische Zeichen einer Dysplasie vorliegen, sind die Diagnosekriterien von MDS erfüllt.
Tabelle 1: Abgrenzung von CHIP und CCUS zu MDS (Hoermann 2022 [2])
|
|
CHIP |
CCUS |
Niedrigrisiko MDS |
Hochrisiko MDS |
|
Klonalität |
+ |
+ |
+ |
+ |
|
Dysplasie |
- |
- |
+ |
+ |
|
Zytopenie |
- |
+ |
+ |
+ |
|
KM Blasten |
<5% |
<5% |
<5% |
5-20% |
|
Zytogenetische Aberrationen |
+/- |
+/- |
+ |
++ |
|
Molekulare Aberrationen |
+ |
+ |
++ |
+++ |
|
Progressionsrisiko |
+ |
++ |
++ |
+++ |
CHIP in der Hämatologie: Diagnostische Methoden und ihre Bedeutung
CHIP in der Hämatologie: Prognose
Die Transformationsrate bei Vorliegen einer CHIP liegt bei 0,17-0,22% pro Jahr (Haferlach & Heuser 2022). Große Klone oder das Vorhandensein mehrerer Mutationen erhöhen das Risiko einer Progression in eine myeloische Neoplasie. Besonders Mutationen in TP53, U2AF1, SRSF2, IDH1, IDH2, SF3B1 und ASXL1 erhöhen das Risiko einer Progression. Zudem gilt das gleichzeitige Vorhandensein mosaikartiger klonaler Veränderungen (nachgewiesen mittels Microarray- oder WGS-Studien) als unabhängiger Risikofaktor für die Entwicklung einer Leukämie (Haferlach & Heuser 2022, WHO 2022, Hoermann 2022 [1], Hoermann 2022 [2]). In der Altersgruppe von ≥80 Jahren ist eine Assoziation von CHIP mit einer geringeren Überlebenswahrscheinlichkeit beschrieben insbesondere bei Vorliegen von ≥2 Mutationen. In dieser Altersgruppe wurde neben spezifischen Mutationsmustern auch eine Allelfrequenz der Mutation von ≥9,6% als Risikofaktor für die Entwicklung einer myeloischen Neoplasie identifiziert (Rossi et al. 2021).
Als prognostischer Risikoscore für die Entwicklung einer hämatologischen Neoplasie wurde im Jahr 2023 der „Clonal Hematopoiesis Risk Score (CHRS) etabliert. In diesen fließen verschiedene Variablen ein, die zur Einteilung in die Risikogruppen niedrig, intermediär und hoch führen. Das alleinige Vorliegen einer DNMT3A-Mutation gilt als prognostisch günstiger Faktor im CHRS. Als prognostisch ungünstige Faktoren gelten hingegen folgende Parameter (Weeks et al. 2023):
- definierte Hochrisiko-Mutation (SRSF2, SF3B1, ZRSR2, IDH1, IDH2, FLT3, RUNX1, JAK2 und TP53)
- Detektion mehrerer Mutationen
- Klongröße von zumindest 20% Varianter Allel Frequenz (VAF)
- Erythrozytenverteilungsbreite (RDW, red cell distribution width) von ≥15%
- Makrozytose definiert als mittleres Erythrozytenvolumen (MCV) von ≥100 fl
- Vorhandensein einer Zytopenie (CCUS vs. CHIP)
- Alter ≥65 Jahre
CHIP als Risikofaktor für die Entwicklung therapieassoziierter myeloischer Neoplasien
CHIP-Klone können unter hämatologischem Stress, der u.a. durch zytotoxische Therapie, Bestrahlung oder Stammzelltransplantation entstehen kann, einen selektiven Überlebensvorteil gewinnen und expandieren. Insbesondere TP53 und PPM1D mutierte Klone werden mit der Entwicklung therapieassoziierter Neoplasien nach zytotoxischer Therapie in Verbindung gebracht (Wong et al. 2015, Coombs et al. 2017, Hsu et al. 2018, Kahn et al. 2018, Wong et al. 2018, Ortmann et al. 2019, Hoermann 2022 [1]).
CHIP im Kontext autologer und allogener Stammzelltransplantation
In wenigen Studien wurde ein erhöhtes Risiko für die Entwicklung einer therapieassoziierten myeloischen Neoplasie nach autologer Stammzelltransplantation beschrieben (Gibson et al. 2017). Nach aktuellem Wissensstand gibt es jedoch keine ausreichende Evidenz CHIP im Kontext einer autologen Stammzelltransplantation zur Therapieentscheidung heranzuziehen.
Bei allogener Stammzelltransplantation beeinflusste der CHIP-Status des Spenders das Gesamtüberleben der Empfänger in einer ersten Studie nicht. Im Kontext CHIP-positiver Stammzellspender wurde eine erhöhte Inzidenz chronischer Graft-versus-Host-Erkrankungen beobachtet, welche mit einer geringeren Rezidiv- bzw. Progressionsrate einherging (Frick et al. 2019). Es gibt allerdings Fallberichte zum Auftreten von Spenderzellleukämien nach allogener Stammzelltransplantation im Zusammenhang mit CHIP-positiven älteren Spendern (Gondek et al. 2016, Frick et al. 2019).
CHIP in der Hämatologie: Empfehlung
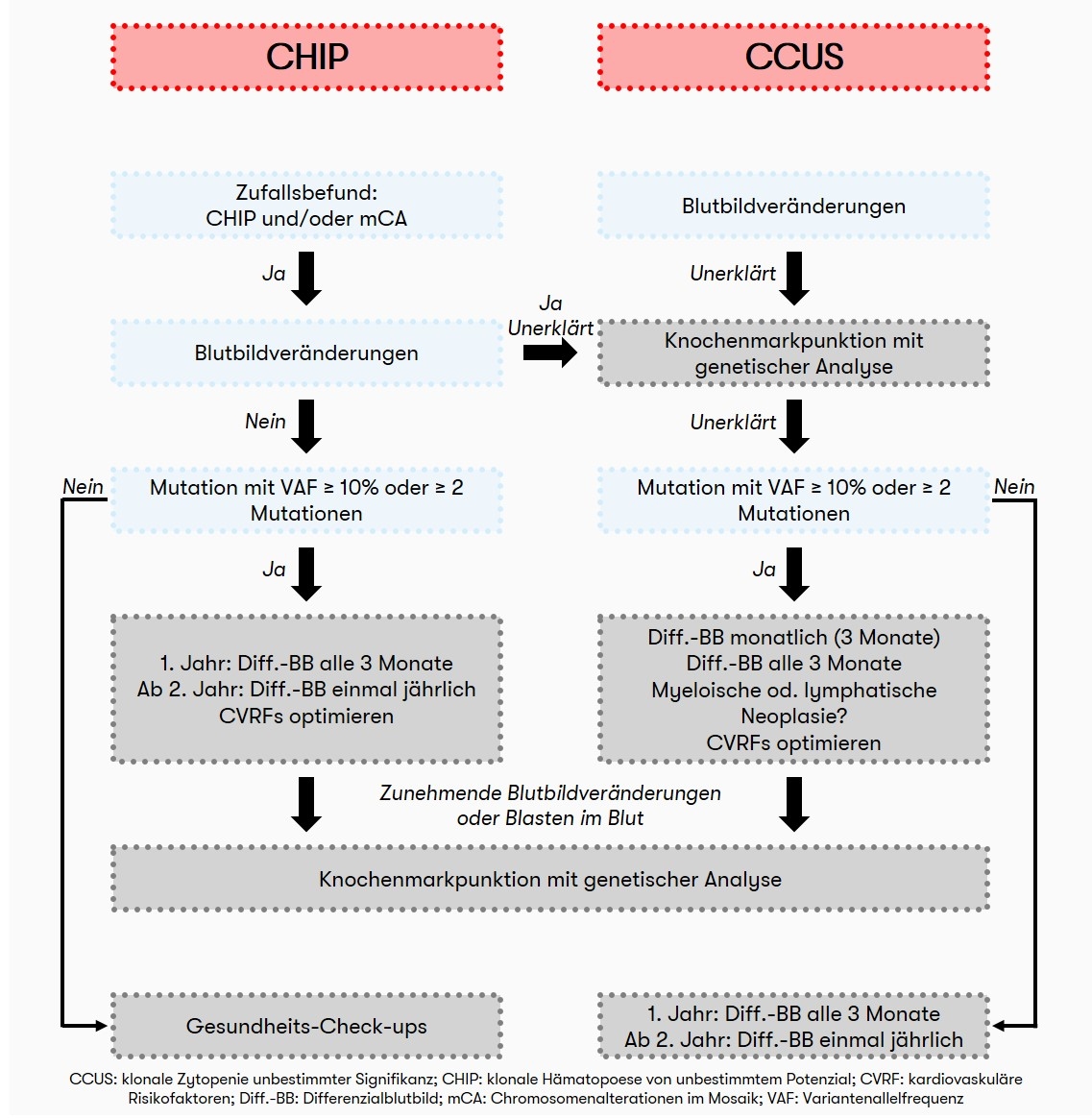
Auch in Anbetracht fehlender Möglichkeiten zur therapeutischen Intervention wird ein Screening auf das Vorliegen einer CHIP bei Personen mit normalem Blutbild aus hämatologischer Sicht derzeit noch nicht empfohlen. Oft handelt es sich beim Nachweis einer klonalen Hämatopoese um einen Zufallsbefund. Bei einem normalen Blutbild sollte bei Patienten mit CHIP in regelmäßigen Abständen (zunächst nach 3 Monaten, später alle 12 Monate) ein Blutbild inklusive Differenzialblutbild erstellt werden, um eine mögliche Progression zu erfassen. Liegt bei dem Patienten eine unerklärte periphere Zytopenie (CCUS) vor, wird initial eine Knochenmarkpunktion und ein Differenzialblutbild nach 1, 2 und 3 Monaten sowie folgend alle 3 Monate empfohlen (Heuser et al. 2016). Eine Empfehlung zum diagnostischen Algorithmus bei CHIP gibt es zudem von Haferlach & Heuser 2022:
Stand: November 2023