Präzisere Rezidiv-Prognose für CML-Patienten: Zelllinien-spezifischer Nachweis bei der messbaren Resterkrankung
- Neue Horizonte in der Leukämieforschung: Ausgewählte Paper im Fokus -
Mit Blick auf präzisere Methoden zur Vorhersage von Rückfällen nach dem Therapieende untersucht eine neue Studie von Pagani et al. die Rolle der Zelllinien-spezifischen Messung von BCR::ABL1-Transkripten mittels quantitativer PCR bei verschiedenen Immunzellpopulationen. Demnach könnte der Nachweis von BCR::ABL1-DNA in Granulozyten und T-Zellen nach dem Absetzen der Therapie ein besserer Prädiktor für Rückfälle sein als der Nachweis in Gesamtleukozyten.
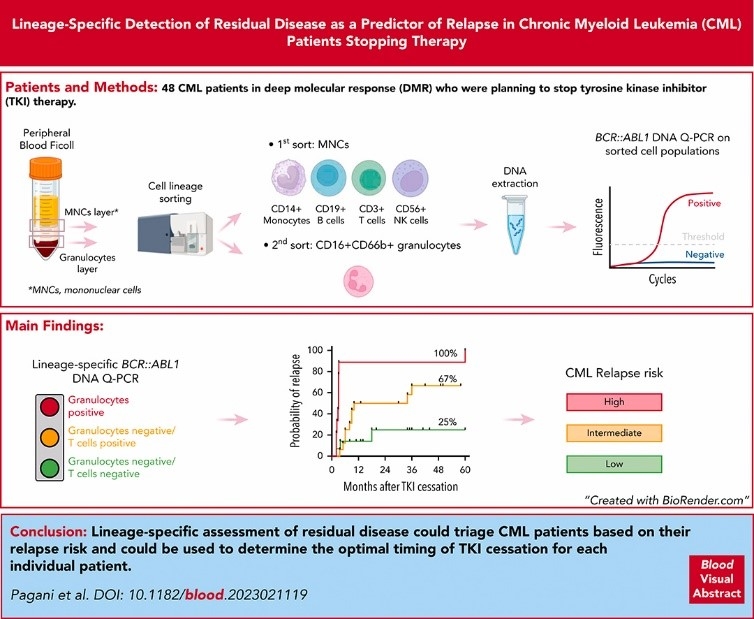
Bei Patienten mit chronischer myeloischer Leukämie (CML), die für eine therapiefreie Remission (TFR) in Frage kommen, kann es auch nach dem Absetzen eines Tyrosinkinase-Inhibitors (TKI) zu einem Rückfall kommen. Es besteht daher ein Bedarf an genauen Prädiktoren – wie zum Beispiel dem sensitiven Nachweis der messbaren Resterkrankung (MRD). Dieser Nachweis kann in seiner Aussagekraft allerdings variieren: Laut den Autoren der hier vorgestellten Publikation könnte dies daran liegen, dass bei der MRD die Gesamt-Leukozytenzahl gemessen wird, obwohl nur bestimmte Zelltypen für das Rezidiv relevant sind. Pagani et al. untersuchten in ihrer prospektiven Studie daher, ob die Messung der BCR::ABL1-Transkriptmenge in verschiedenen Immunzellpopulationen (Granulozyten, T-Zellen, NK-Zellen, B-Zellen und Monozyten) mittels quantitativer real-time PCR (qPCR) das Risiko für ein Rezidiv nach Absetzen der TKI-Therapie bei Patienten mit CML vorhersagen kann. Dafür wurden 47 CML-Patienten, die planten, die TKI-Therapie abzusetzen, analysiert und für bis zu fünf Jahre nachbeobachtet. 40 dieser Patienten, die zum ersten Mal versuchten, eine TFR zu erreichen, wurden für die nachfolgenden prädiktiven Analysen ausgewählt.
Der Nachweis von BCR::ABL1-DNA war in den Gesamtleukozyten mit einer höheren kumulativen Inzidenz von Rückfällen nach 60 Monaten (70% gegenüber 30%; P=0,023) assoziiert. Die höchste Transkriptmenge wurde in Granulozyten nachgewiesen (100% vs. 49%; P<0,0001), gefolgt von T-Zellen (73% vs. 30%; P=0,022). Mithilfe multivariater Analyse konnten Pagani et al. drei Patientengruppen definieren: Granulozyten-positiv, Granulozyten-negativ/T-Zell-positiv und Granulozyten-negativ/T-Zell-negativ mit einem hohen, intermediären bzw. niedrigen Rezidivrisiko. Die Genauigkeit dieses Modells betrug 77%.
Die Autoren gehen davon aus, dass durch eine Zelllinien-spezifische MRD-Messung solche Patienten identifiziert werden können, die die TKI-Therapie sicher beenden können. Zudem könne so der optimale Zeitpunkt für ein Therapieende gefunden werden. Pagani et al. kommen außerdem zu dem Schluss, dass der Nachweis von BCR::ABL1-DNA in Granulozyten und T-Zellen bei Absetzen des TKI ein besserer Prädiktor für ein Rezidiv ist als der Nachweis in Gesamtleukozyten.
Pagani IS et al. Lineage-specific detection of residual disease predicts relapse in patients with chronic myeloid leukemia stopping therapy. Blood 2023;142(25):2192-2197.

»Bei weiteren Fragen zum Thema und zu Publikationen des MLL kontaktieren Sie uns gern!«
Dr. rer. nat. Constanze Kühn
Medical Writer