CHIP ist von hoher Relevanz für das individuelle Risikoprofil bei Personen im Alter von ≥80 Jahren
Klonale genetische Veränderungen in hämatopoetischen Zellen treten mit fortschreitendem Alter immer häufiger auch bei Personen ohne hämatologische Neoplasie auf. Durch die wachsende Anzahl an Personen im Alterssegment von ≥80 Jahren in unserer Gesellschaft ergibt sich die Notwendigkeit der Erforschung der klinischen Relevanz einer solchen klonalen Hämatopoese (CHIP). Im Fokus steht dabei der Zusammenhang von CHIP mit der Entwicklung myeloischer Neoplasien oder kardiovaskulärer Erkrankungen für eine individuelle Risikoeinschätzung und potenzielle frühe therapeutische Intervention.
Eine kürzlich publizierte Studie von Rossi und Kollegen (Blood 2021;138 (21): 2093–2105) untersuchte Blutproben von 1794 Personen im Alter von ≥80 Jahren ohne diagnostizierte hämatologische Neoplasie auf Mutationen in 47 Genen, die bei myeloischen Neoplasien eine Rolle spielen.
Häufigkeit von CHIP und Effekt auf das Überleben bei Personen ≥80 Jahren
- CHIP bei ca. 30% der Individuen
- je älter die Person, desto häufiger CHIP
- CHIP häufiger bei Individuen mit (nicht-hämatologischen) chronischen Erkrankungen
- geringere Überlebenswahrscheinlichkeit für Personen mit CHIP v.a. bei ≥2 Mutationen
Bei ca. 30% der Individuen wurde mindestens eine Mutation in einem der untersuchten Gene nachgewiesen, wobei am häufigsten die Gene DNMT3A, TET2 und ASXL1 betroffen waren. Je älter die Person, desto häufiger konnten CHIP-Mutationen nachgewiesen werden. CHIP-Mutationen traten ferner ca. dreimal so häufig bei Individuen mit nicht-hämatologischen chronischen Erkrankungen auf. Zudem hatten Personen mit CHIP eine geringere Überlebenswahrscheinlichkeit, wobei Personen mit ≥2 Mutationen eine noch ungünstigere Prognose zeigten (Beobachtungszeitraum bis zu 15 Jahre).
Einfluss von CHIP auf das Risiko für myeloische Neoplasien
- Abwesenheit von CHIP: hoher negativer Vorhersagewert
- Anzahl, Art und Klongröße der Mutationen als prädiktive Marker für myeloische Neoplasien
- Definition von 3 Risikogruppen mittels Mutationsstatus und Erythrozyten-Indizes
- hohe prognostische Relevanz von Mutationen bei unklarer Zytopenie
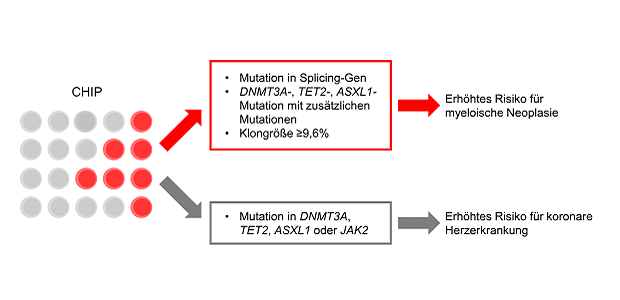
Rossi und Kollegen konnten zeigen, dass CHIP-Mutationen in der untersuchten Kohorte das Risiko beeinflussen, eine myeloische Neoplasie zu entwickeln. Die Abwesenheit von CHIP stellte sich dabei als starker negativer Prädiktor heraus. Eine höhere Anzahl an Mutationen sowie Mutationen in Splicing-Genen (SF3B1, SRSF2, U2AF1, ZRSR2), JAK2-Mutationen und DNMT3A-, TET2- und ASXL1-Mutationen mit Mutationen in weiteren Genen zeigten einen starken positiven Vorhersagewert für die Entwicklung von myeloischen Neoplasien. Das Risiko für eine myeloische Neoplasie war ebenfalls erhöht, wenn die Allelfrequenz der Mutation ≥9,6% betrug. Anhand eines Risikoscores basierend auf dem Mutationsstatus, dem mittleren Erythrozytenvolumen (MCV >98 fL) und der Erythrozytenverteilungsbreite (RDW >14%) wurden drei Risikogruppen für das Auftreten einer myeloischen Neoplasie definiert. Die Kombination einer unklaren Zytopenie mit spezifischen Mutationen (klonale Zytopenie von unklarer Signifikanz, CCUS) war prognostisch besonders ungünstig. Das Gesamtüberleben von Personen mit dieser Konstellation unterschied sich nicht von Patienten mit einer diagnostizierten myeloischen Neoplasie.
CHIP und chronische entzündliche Erkrankungen bzw. koronare Herzerkrankungen bei Personen ≥80 Jahren
Auch das Risiko für koronare Herzerkrankungen war bei Individuen mit CHIP-Mutationen erhöht. Als Hochrisikomutationen stellten sich dabei DNMT3A-, TET2-, ASXL1- oder JAK2-Mutationen heraus, welche darüber hinaus auch auf ein erhöhtes Risiko für rheumatoide Arthritis hinwiesen.
Die Studie von Rossi und Kollegen zeigt die Bedeutung von CHIP für die individuelle Risikoeinschätzung und Prognose insbesondere bei älteren Personen. Eine Mutationsanalyse kann vor allem für die weitere Einordnung einer ungeklärten Zytopenie hilfreich sein. Basierend auf Forschungsergebnissen wie diesen erwägen wir stets Anpassungen und Ergänzungen unseres diagnostischen Angebots, um potenzielle Risikofaktoren frühzeitig zu identifizieren.
Die Autorin

»Sie haben Fragen zum Artikel oder wünschen weitere Informationen? Schreiben Sie mir gerne eine E-Mail.«
Dr. rer. nat. Isolde Summerer
Diplombiologin
Bereichsleitung Zytogenetik
Abteilungsleitung Chromosomenanalyse-Befundung
Stellv. Abteilungsleitung FISH-Befundung
isolde.summerer@mll.com