Klonale Zytopenie unbestimmter Signifikanz (CCUS)
- Methode:
- Antikoagulans:
- Empfehlung:
- Methode:Zytomorphologie
- Antikoagulans:EDTA
- Empfehlung:obligat
- Methode:Immunphänotypisierung
- Antikoagulans:
- Empfehlung:nein
- Methode:Chromosomenanalyse
- Antikoagulans:Heparin
- Empfehlung:obligat
- Methode:FISH
- Antikoagulans:EDTA oder Heparin
- Empfehlung:fakultativ
- Methode:Molekulargenetik
- Antikoagulans:EDTA oder Heparin
- Empfehlung:obligat
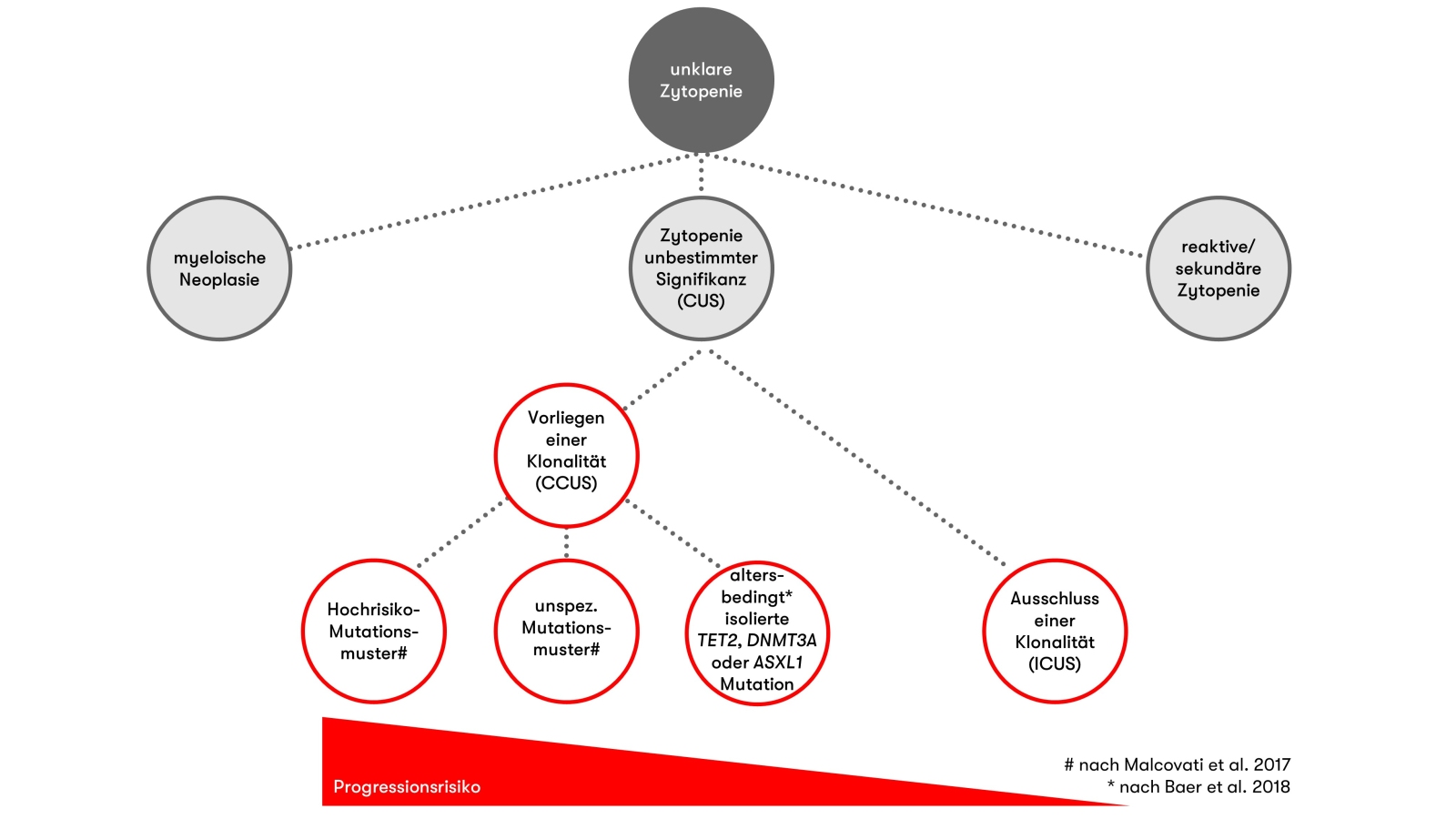
Unklare, anhaltende Zytopenien sind bei älteren Patienten ein häufiges Bild im klinischen Alltag. In circa einem Drittel der Fälle ist neben der Zytopenie auch eine klonale Hämatopoese nachweisbar - womit die diagnostischen Kriterien für die Diagnose einer klonalen Zytopenie unbestimmter Signifikanz (CCUS) erfüllt sind. Wir haben die wichtigsten Informationen zur Klassifikation, Diagnose und Prognose der klonalen Zytopenie unbestimmter Signifikanz für Sie zusammengestellt.
Klassifikation der klonalen Zytopenie unbestimmter Signifikanz
Mit der 5. Edition wird die klonale Zytopenie unbestimmter Signifikanz erstmalig in der WHO-Klassifikation aufgeführt, sie zählt zu den myeloischen Vorläufererkrankungen (WHO 2022).
Diagnostische Kriterien (WHO 2022)
- Nachweis einer klonalen Hämatopoese*
- Eine oder mehrere persistierende (>4 Monate) Zytopenie(n), die nicht anderweitig erklärt werden kann/können
- Diagnostische Kriterien für definierte myeloische Neoplasien sind auf Basis einer Knochenmark-Untersuchung nicht erfüllt
*Detektion einer oder mehrerer chromosomaler Aberrationen bzw. einer oder mehrerer somatischer Mutationen mit einer Allelfrequenz von ≥2% (bzw. ≥4% bei X-chromosomalen Genmutationen bei Männern), inklusive Mutationen in bestimmten Genen (vgl. Molekulargenetik, Tabelle 1):
Abgrenzung von CCUS zu CHIP und MDS
Die klonale Zytopenie unbestimmter Signifikanz ist abzugrenzen von der klonalen Hämatopoese von unbestimmtem Potenzial (CHIP, clonal hematopoiesis of indeterminate potential), bei der erworbene molekulargenetische Veränderungen nachweisbar sind, jedoch keine Zytopenie vorliegt.
Gemein sind der CCUS und der myelodysplastischen Neoplasie (MDS) Zytopenie(n) sowie klonale Veränderungen, allerdings sind bei einer CCUS die diagnostischen Kriterien für die Einteilung nach WHO 2022 in die MDS-Subgruppen „MDS mit definierenden genetischen Veränderungen“ bzw. „MDS, morphologisch definiert“ nicht erfüllt.
Weiterführende Informationen zu MDS und der MDS-Diagnostik finden Sie hier.
Diagnostische Methoden bei klonaler Zytopenie unbestimmter Signifikanz
Prognose bei klonaler Zytopenie unbestimmter Signifikanz
Prädiktiver und prognostischer Wert der klonalen Hämatopoese bei unklaren Zytopenien
Bereits der Nachweis bzw. Ausschluss einer Klonalität besitzt prognostische Relevanz und Nutzen für die Differenzialdiagnostik. Kann keine Mutation nachgewiesen werden, ist die Wahrscheinlichkeit, dass zum Zeitpunkt der Untersuchung oder im Follow-up eine myeloische Neoplasie diagnostiziert wird, gering (hoher negativer Vorhersagewert) (Malcovati et al. 2017, Shanmugam et al. 2019, Rossi et al. 2021).
Anzahl, Art und Klongröße der nachgewiesenen Veränderungen beeinflussen das Risiko für eine hämatologische Neoplasie
Eine klonale Hämatopoese ist mit einer erhöhten Wahrscheinlichkeit assoziiert, dass eine hämatologische Neoplasie besteht oder im späteren Verlauf auftritt. Der positive Vorhersagewert für das Vorliegen einer myeloischen Neoplasie lässt sich maximieren, wenn eine höhere Allelfrequenz (≥10% bzw. ≥20%) und/oder das Vorliegen von ≥2 Genmutationen als Kriterien angewandt werden (Malcovati et al. 2017, Shanmugam et al. 2019, Zheng et al. 2019, Galli et al. 2021). Auch bestimmte Mutationen sind prädiktiv für ein MDS – hierzu zählen insbesondere Mutationen in Spliceosom-Faktoren (SF3B1, SRSF2, U2AF1, ZRSR2) (Malcovati et al. 2017, Shanmugam et al. 2019, Galli et al. 2021) oder RUNX1 und JAK2 (Malcovati et al. 2017). Liegen DNMT3A-, TET2- oder ASXL1-Mutationen in Kombination mit mindestens einer weiteren Mutation vor, so ist auch dieses Mutationsmuster prädiktiv für ein MDS (Malcovati et al. 2017, Galli et al. 2021). Eine Studie zur Bedeutung der klonalen Hämatopoese bei Individuen ≥80 Jahren zeigte, dass das Gesamtüberleben von Personen mit einer unklaren Zytopenie in Kombination mit spezifischen Mutationen sich nicht von Patienten mit einer diagnostizierten myeloischen Neoplasie unterscheidet (Rossi et al. 2021).
Die Studie von Malcovati et al. (2017) zeigt ein Progressionsrisiko in eine myeloische Neoplasie von ca. 20% pro Jahr für Patienten mit Zytopenie und den oben genannten spezifischen Mutationsmustern. Der Nachweis anderer Mutationen oder Mutationskonstellationen bei persistierender Zytopenie ging mit einem geringeren Risiko für eine Progression in eine myeloische Neoplasie einher (Progressionsrisiko von ca. 10% pro Jahr). Galli et al. (2021) fanden eine Assoziation von Mutationen in DTA-Genen (DNMT3A, TET2, ASXL1) und SF3B1 oder TP53 und zusätzlichen Mutationen mit Myelodysplasien bereits bei einer Allelfrequenz von <20%. Mutationsmuster unter Involvierung von SRSF2, isolierte oder multiple DTA Mutationen, oder andere multiple Mutationen waren hingegen erst ab einer Allelfrequenz von >30% mit Dysplasien assoziiert.
Einen Rahmen für die prognostische Einschätzung des Progressionsrisikos in eine hämatologische Neoplasie bietet der „Clonal Hematopoiesis Risk Score (CHRS)“. In diesem werden verschiedene Variablen untersucht und eine Einteilung in die Risikogruppen niedrig, intermediär und hoch vorgenommen. Als prognostisch günstiger Faktor wird im CHRS das alleinige Vorliegen einer DNMT3A-Mutation bewertet. Prognostisch ungünstige Faktoren sind hingegen folgende (Weeks et al. 2023):
- definierte Hochrisiko-Mutation (SRSF2, SF3B1, ZRSR2, IDH1, IDH2, FLT3, RUNX1, JAK2 und TP53)
- Detektion mehrerer Mutationen
- Klongröße von zumindest 20% Varianter Allel Frequenz (VAF)
- Erythrozytenverteilungsbreite (RDW, red cell distribution width) von ≥15%
- Makrozytose definiert als mittleres Erythrozytenvolumen (MCV) von ≥100 fl
- Vorhandensein einer Zytopenie (CCUS vs. CHIP)
- Alter ≥65 Jahre
Empfehlung bei klonaler Zytopenie unbestimmter Signifikanz
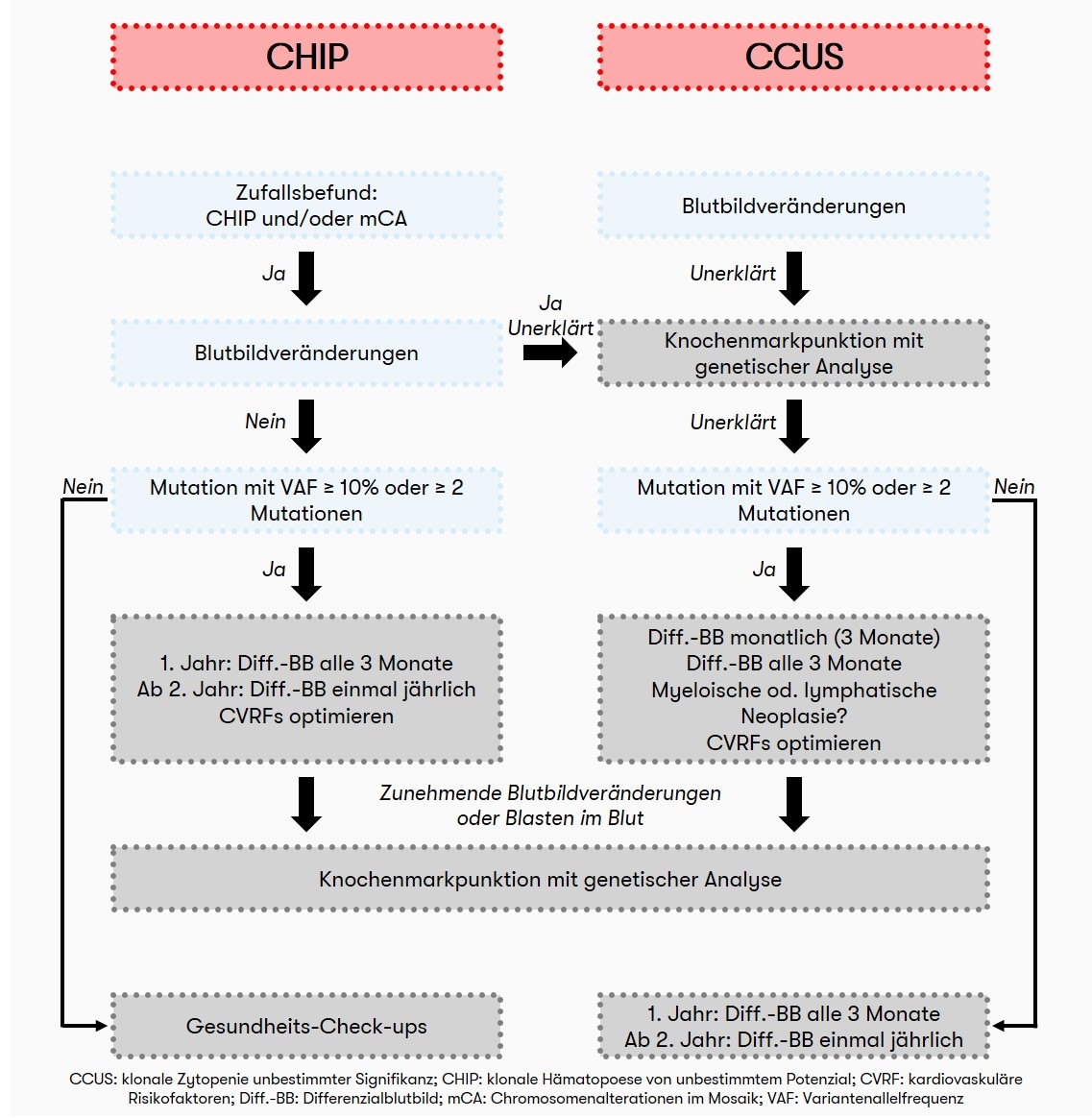
Ist das individuelle Progressionsrisiko (vgl. auch Prognose) stark erhöht, insbesondere bei einer oder mehrerer Mutationen mit einer Allelfrequenz ≥10% oder dem Vorliegen von ≥2 Mutationen, empfiehlt sich ein vierteljährliches Monitoring per Differentialblutbild hinsichtlich der Progression in eine hämatologische Neoplasie. In Fällen mit geringerem Progressionsrisiko liegt die Empfehlung im ersten Jahr bei einem vierteljährigen Turnus und ab dem zweiten Jahr bei einem jährlichen Monitoring (Haferlach & Heuser 2022, vgl. auch Abbildung 2).
Stand: März 2024