MDS/MPN-N (Myelodysplastische / myeloproliferative Neoplasie mit Neutrophilie)
- Methode:
- Antikoagulans:
- Empfehlung:
- Methode:Zytomorphologie
- Antikoagulans:EDTA
- Empfehlung:obligat
- Methode:Immunphänotypisierung
- Antikoagulans:EDTA oder Heparin
- Empfehlung:fakultativ
- Methode:Chromosomenanalyse
- Antikoagulans:Heparin
- Empfehlung:obligat
- Methode:FISH
- Antikoagulans:
- Empfehlung:nein
- Methode:Molekulargenetik
- Antikoagulans:EDTA oder Heparin
- Empfehlung:obligat
Auf Basis der aktuellen Leitlinien und des aktuellen Forschungsstandes ergeben sich verschiedene diagnostische Empfehlungen für Patienten mit MDS/MPN-N (Myelodysplastischer /myeloproliferativer Neoplasie mit Neutrophilie). Wir haben Ihnen die wichtigsten Infos zur Klassifikation und den diagnostischen Methoden am MLL zusammengefasst.
MDS/MPN-N: Klassifikation
Bei der Myelodysplastischen/myeloproliferativen Neoplasie mit Neutrophilie (MDS/MPN-N) handelt es sich um eine myeloische Neoplasie mit myelodysplastischen und myeloproliferativen Merkmalen, die durch anhaltende Neutrophilie im peripheren Blut und neutrophile Linksverschiebung gekennzeichnet ist (Khoury et al. 2022). Die Bezeichnung MDS/MPN-N wurde im Jahr 2022 mit Erscheinen der neuen WHO-Klassifikation eingeführt und ersetzt in dieser die Bezeichnung der Entität als atypische chronische myeloische Leukämie (aCML), BCR::ABL1-negativ. Die Änderung des Namens unterstreicht den myelodysplastischen / myeloproliferativen Charakter der Erkrankung und soll Verwechslungen mit der chronischen myeloischen Leukämie (CML) vermeiden (Khoury et al. 2022). In der ebenfalls 2022 erschienenen International Consensus Classification (ICC) wird die Entität unter dem Namen atypische chronische myeloische Leukämie geführt (Arber et al. 2022).
Tabelle 1: Diagnostische Kriterien bei MDS/MPN-N (Khoury et al. 2022)
|
Essentiell:
|
|
Wünschenswert:
|
* Die Diagnose von MDS/MPN-N erfordert den Ausschluss eines BCR::ABL1-Fusionsgens, was eine sorgfältige Untersuchung zum Ausschluss kryptischer Rearrangements und/oder alternativer BCR::ABL1-Transkripte mit den verfügbaren Methoden (z. B. Zytogenetik, Fluoreszenz-in-situ-Hybridisierung oder PCR-basierte Analysen) erfordert.
** Mutationen in diesen Genen sind bei MDS/MPN-N ungewöhnlich und sollten Anlass für eine morphologische Untersuchung sein, um alternative Diagnosen auszuschließen.
MDS/MPN-N: Diagnostische Methoden und ihre Bedeutung
MDS/MPN-N: Prognose
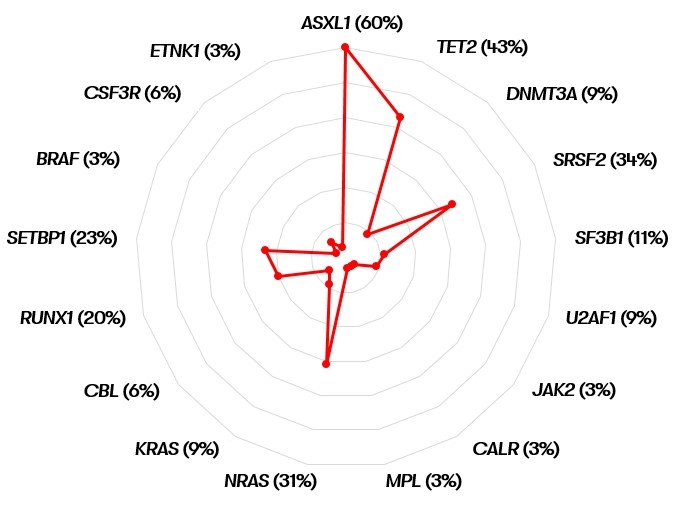
Das mediane Überleben von MDS/MPN-N-Patienten liegt bei 14-29 Monaten (Khoury et al. 2022). Da es sich jedoch um eine seltene Krankheit handelt, gibt es keinen einheitlichen Konsens über die Risikostratifizierung (Patnaik & Tefferi 2023). Als prognostisch-negativer Parameter bei MDS/MPN-N wurde in mehreren Studien eine Leukozytenzahl von >50x109/L beschrieben (Onida et al. 2002, Breccia et al. 2006, Wang et al. 2014, Khoury et al. 2022). In einzelnen dieser Studien waren zudem ein Alter >65 Jahre, weibliches Geschlecht und ein Hämoglobinspiegel von <10 g/dL prognostisch ungünstig. Außerdem zeigte sich ein negativer Einfluss einer SETBP1-Mutation (Piazza et al. 2013, Khoury et al. 2022, Patnaik & Tefferi 2023). 30-40% der Patienten zeigen eine Transformation in eine AML (Wang et al. 2014).
MDS/MPN-N: Empfehlung
Es ist zu beachten, dass gemäß WHO 2022 im Rahmen der Differentialdiagnosen bei Nachweis einer CSF3R-Mutation morphologisch eine CNL ausgeschlossen werden sollte. Ebenso sollte bei Nachweis einer JAK2-, CALR- oder MPL-Mutation anhand der Historie eine akzelerierte Phase einer MPN ausgeschlossen werden.
Im Gegensatz dazu stützt nach WHO 2022 das Vorliegen einer SETBP1- oder ETNK1-Mutation die Diagnose einer MDS/MPN-N (Khoury et al. 2022).
Stand: Juni 2023