BAX Mutationen vermitteln Venetoclax Resistenz in AML
Der Entwicklung gezielter Therapien zur Behandlung hämatologischer Neoplasien hat in den vergangenen Jahren eine Vielzahl von erfolgversprechenden Medikamenten hervorgebracht. Darunter besonders hervorzuheben sind Substanzen, die den programmierten Zelltod (Apoptose) durch Hemmung antiapoptotischer Proteine, z.B. BCL2, induzieren. Der derzeit bekannteste Vertreter dieser Substanzklasse ist das Venetoclax. Allerdings tritt auch hier wie bei vielen anderen gezielten Therapien häufig das Problem der Resistenzbildung im Verlauf der Behandlung auf.
Einsatz von Venetoclax bei der Therapie der AML
Der Einsatz von Venetoclax hat insbesondere die Therapie von AML-Patienten verändert, die nicht für die Behandlung mit intensiver Hochdosis-Chemotherapie in Frage kommen. Bei diesen Patienten handelt es sich meist um ältere bzw. unfitte Patienten. Als Standard-Behandlungsoption für eine neu diagnostizierte AML kristallisiert sich hier die Kombination von Venetoclax mit hyomethylierenden Substanzen oder mit niedrig dosiertem Cytarabin heraus1,2. Da es häufig im Behandlungsverlauf zu einer Resistenzbildung und Erkrankungsprogression kommt, ist die Aufklärung der zugrunde liegenden Mechanismen Gegenstand intensiver Forschung.
Mechanismen der Resistenzbildung
Zu bereits bekannten Resistenzmechanismen bei der Behandlung mit Venetoclax gehören Mutationen in Genen wie TP53 sowie K/NRAS. Darüber hinaus ist auch die FLT3-ITD ein entsprechender Risikofaktor3,4. Keine Rolle dagegen spielen Mutationen in BCL2, einem der “targets” von Venetoclax, die bereits aus Untersuchungen zur CLL bekannt sind.
Ein neu entdecktes Kandidatengen, das bei der AML eine Rolle spielt, ist das proapoptotische BAX Gen. Darüber wird in einer aktuellen Publikation in Blood von der Gruppe von Moujalled et al. berichtet5.
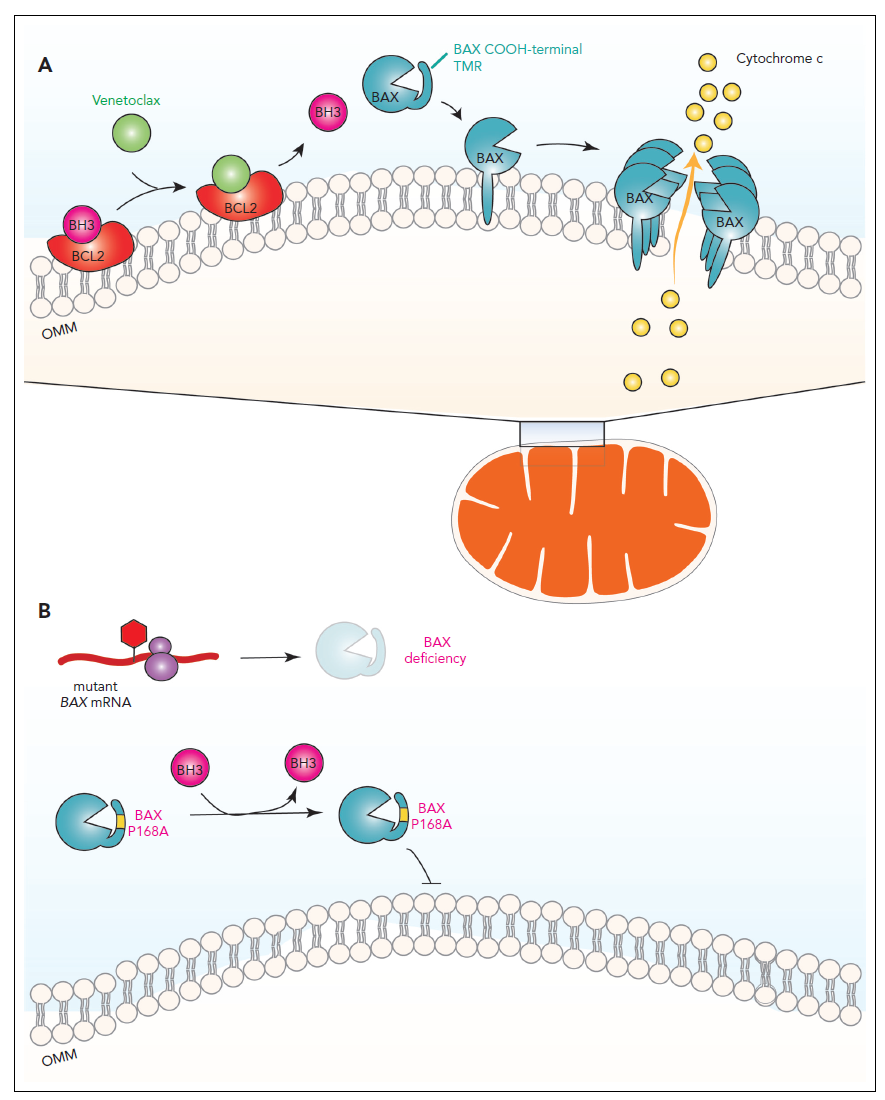
Apoptose-Induktion durch Venetoclax und Inhibition der Apoptose durch BAX Mutationen
Die
Mechanismen der Apoptose-Induktion sind in der Abbildung dargestellt
(übernommen aus Kim WJ et al.,
Blood 2023, Comment on Moujalled et al.). Hierbei wird die Apoptose letztendlich
durch die Bindung von BAX an die
äußere mitochondriale Membran ausgelöst. Es kommt zu einer BAX-vermittelten Permeabilisierung der Membran, die wiederum zum
Entlassen von Cytochrom c aus dem Inneren der Mitochondrien ins Zytosol der
Zelle führt. Für die Aktivierung von BAX
zur Bindung an die äußere mitochondriale Membran sind zwei Schritte entscheidend:
- BCL2 muss durch ein sogenanntes proapoptotisches “BH3 only” Protein oder durch das BH3-Mimetikum Venetoclax als alternativer Ligand gebunden werden.
- Durch
einen Überschuss an Venetoclax kommt es neben der Bindung von BCL2 gleichzeitig
zu einer verstärkten Freisetzung der “BH3-only” Proteine, die als zweite Funktion die Aktivierung von BAX haben.
Die Aktivierung von BAX kann nun durch zweierlei Arten von BAX Mutationen verhindert werden. Zum einen durch erworbene frameshift bzw. nonsense Mutationen, die die BAX Proteinmenge reduzieren oder durch missense Mutationen, die die Permeabilisierung der äußeren mitochondrialen Membran durch BAX verhindern.
Referenzen
- DiNardo CD, Jonas BA, Pullarkat V, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med. 2020;383(7):617-629.
- Wei AH, Montesinos P, Ivanov V, et al. Venetoclax plus LDAC for newly diagnosed AML ineligible for intensive chemotherapy: a phase 3 randomized placebo-controlled trial. Blood. 2020;135(24):2137-2145.
- DiNardo CD, Tiong IS, Quaglieri A, et al. Molecular patterns of response and treatment failure after frontline venetoclax combinations in older patients with AML. Blood. 2020;135(11):791-803.
- Thijssen R, Diepstraten ST, Moujalled D, et al. Intact TP-53 function is essential for sustaining durable responses to BH3-mimetic drugs in leukemias. Blood. 2021;137(20):2721-2735.
- Moujalled DM, Brown FC, Chua CC, et al. Acquired mutations in BAX confer resistance to BH3-mimetic therapy in acute myeloid leukemia. Blood. 2023;141(6):634-644.
Der Autor

»Sie haben Fragen zum Artikel oder wünschen weitere Informationen? Schreiben Sie mir gerne eine E-Mail.«
Dr. rer. nat. Frank Dicker